Este diagrama muestra la nomenclatura para las diferentes transiciones de fase su relación con la variación de la
entalpía.

Animación de cómo el
hielo pasa a estado líquido en un vaso. Los 50 minutos transcurridos se concentran en 5 segundos.
CAMBIOS DE ESTADO DE AGREGACIÓN DE LA MATERIA
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Desionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a un plasma.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.
Las diferentes transformaciones de fase de la materia en este caso las del agua son necesarias y provechosas para la vida y el sustento del hombre cuando se desarrollan normalmente.
Los cambios de estado están divididos generalmente en dos tipos: progresivos y regresivos.
- Cambios progresivos: Vaporización, fusión y sublimación progresiva.
- Cambios regresivos: Condensación, solidificación y sublimación regresiva
La siguiente tabla indica cómo se denominan los cambios de estado:
También se puede ver claramente con el siguiente gráfico:
PUNTO DE FUSIÓN
Al efecto de fundir un
metal se le llama fusión (no podemos confundirlo con el punto de fusión). También se suele denominar fusión al efecto de
licuar o
derretir una sustancia sólida, congelada o pastosa, en líquida.
En la mayoría de las sustancias, el punto de fusión y de
congelación, son iguales. Pero esto no siempre es así: por ejemplo, el
agar-agar se funde a 85 °C y se solidifica a partir de los 31 °C a 40 °C; este proceso se conoce como
histéresis.
En
geología, se denomina punto de
solidus a la temperatura en la que empieza a fundirse una
roca y punto de
liquidus a la temperatura en la que la fusión es total. Tanto la presencia de agua como una disminución de la presión pueden rebajar los puntos de
solidus y
liquidus de una roca, facilitando la formación de
magmas sin aumentar la temperatura.
1
PUNTO DE EBULLICIÓN
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso, es decir se ebulle. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido. En esas condiciones se puede formar vapor en cualquier punto del líquido.
La temperatura de una sustancia o cuerpo depende de la
energía cinética media de las
moléculas. A temperaturas inferiores al punto de
ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la
tensión superficial y escapar. Este incremento de energía constituye un intercambio de
calor que da lugar al aumento de la
entropía del sistema (tendencia al desorden de las
partículas que lo componen).














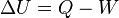 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una 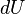 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.